Ķīmiskā formula ir vienkāršots, standarta apzīmējums, lai izskaidrotu eksperimentos izmantoto ķīmisko reakciju. Tie var izskatīties sarežģīti, bet, iemācoties tos lasīt, tie kļūst diezgan pašsaprotami.
Aplūkojiet ķīmisko reakciju, kuru mēģināt sadalīt, kā vienādojumu. Meklējiet atslēgas vārdus, īpaši iesaistītos ķīmiskos komponentus. Piemēram, tiek sadedzināts metāns (CH4), kas vienmēr nozīmē, ka tas tiek darīts skābeklī (O2). Tas rada gan oglekļa dioksīda (CO2), gan ūdens (H2O) tvaikus. Ievērojiet vārda "Ienesīgums" atrašanās vietu, jo tas ir svarīgi.
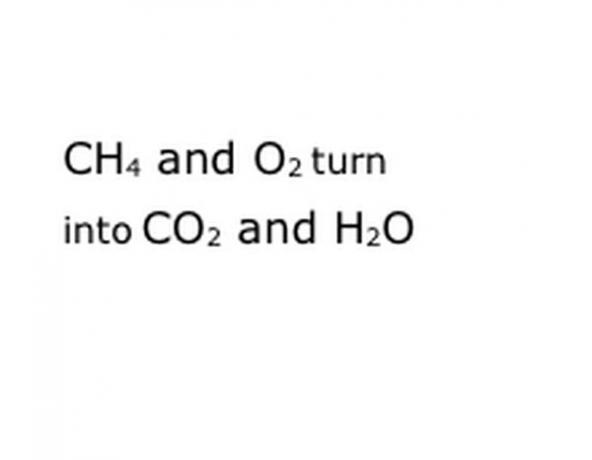
Rakstiet reakcijas ķīmiskos komponentus standarta pieraksta formātā. Mūsu piemērā tas būs CH4, O2, CO2 un H2O. Ķīmijā "raža" nozīmē, ka viss, kas ir iepriekš, pārvēršas par visu, kas nāk pēc tam, tāpēc pārliecinieties, ka "raža" ir aptuveni pa vidu. Šī frāze attēlos faktisko ķīmisko reakciju, šajā gadījumā dedzināšanu. Tātad visam, ko jūs sadedzināsiet, jābūt pirms tā, un visam, kas rodas reakcijai, jābūt pēc tam.
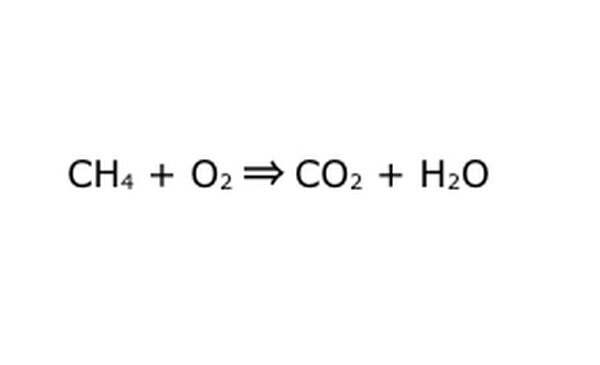
Pārrakstiet vienādojumu kā matemātisku procesu. Aizstājiet “iznākums” vai “pārvēršas” ar bultiņu un starp ķīmiskajiem komponentiem uzzīmējiet plus zīmes. Lai vienkāršotu lietas, domājiet par katru ķīmisko komponentu kā par atsevišķu molekulu. Tas var palīdzēt molekulas izvilkt uz papīra lūžņu. Pārliecinieties, ka visas molekulas, kas nonāk, ir attēlotas, kā tās iznāk. Ja galaproduktā kaut kā trūkst, varat to pievienot jēgpilnā veidā - pārbaudiet visu, salīdzinot ar to, ko zināt par kovalento savienojumu. Tā kā lielākā daļa eksperimentu tiek veikti parastajā atmosfērā, degšanas reakcijām, ja nepieciešams, varat pievienot O2. Ja vienādojums ir atgriezenisks, pārliecinieties, ka tam ir divkārša bultiņa, kas to apzīmē.
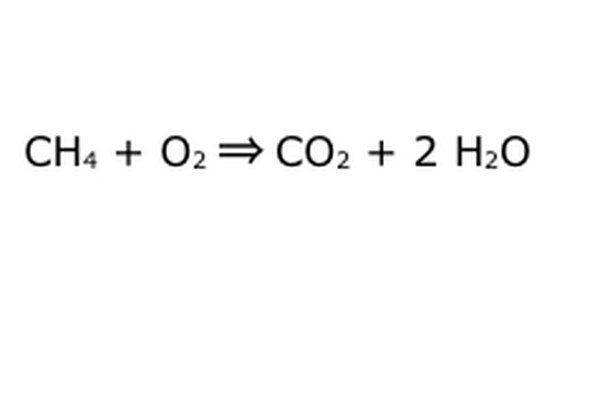
Līdzsvarojiet savu vienādojumu. Šeit darbojas Konservācijas likums: domājiet par bultiņu, mūsu reakciju kā par mašīnu, kurā jūs esat iemetis visus komponentus pa kreisi. Iekārta neradīs un nepievienos neko, ko neievietojāt, un tāpēc tas izspļaus tikai tādu pašu daudzumu jūsu ievietoto lietu. Šajā precīzajā brīdī mums apkārt peld divas ūdeņraža molekulas, jo jūs ievietojat "4". Vienīgā vieta, kur tā var nokļūt šajā mašīnā, ir vienā no produktiem, tāpēc tai būs jāiet ūdens molekulās. Uzrakstiet "2" H2O priekšā, lai norādītu, ka par katru ievietoto CH4 jūs saņemsit divus H2O atpakaļ.

Ņemiet vērā, ka joprojām pastāv neliela problēma ar mūsu vienādojumu: nepietiek skābekļa. Ir četri skābekļa atomi, kas iziet, bet tikai divi iet iekšā, un tāpēc visa lieta joprojām nav līdzsvarota. Uzrakstiet "2" O2 priekšā, lai parādītu, ka jums ir jāievieto divi O2, lai iegūtu pietiekami daudz reakcijas.
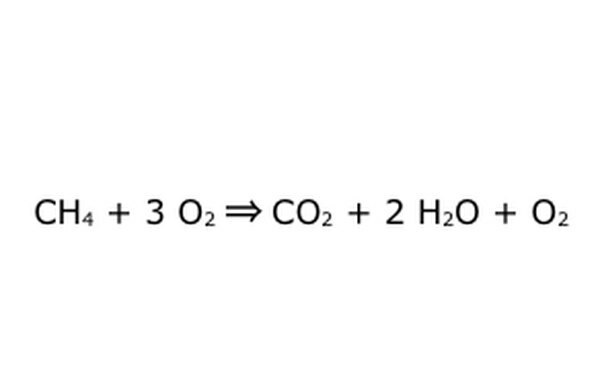
Ņemiet vērā, ka ir iespējams veikt šādu procesu "skābekļa pārpalikumā". Tas nozīmē, ka vienādojums ieliek vairāk skābekļa, nekā nepieciešams, un atgūst vairāk. Piemēram, ņemiet vērā, ka iekšpusē ir papildu O2, tāpēc rodas papildu. Tikai pārliecinieties, ka Konservācijas likums tiek ievērots vienmēr. Visam, kas ienāk, ir jāiznāk.
Padomi
Parasti ķīmiskās vielas šāda veida vienādojumos mēra molos. Mols ir vienība, kas apzīmē 6.0221415 10 ^ (23) molekulas. Tā kā šis skaitlis ir pārāk liels, lai to saprastu, līdzsvarojot ir vieglāk domāt par atsevišķām molekulām. Sāciet to apzināties.
