კინეტიკა არის ფიზიკური ქიმიის დარგი, რომელიც შეისწავლის ქიმიური რეაქციების სიჩქარეს. ამის საპირისპიროდ, თერმოდინამიკა გვეუბნება რეაქციის რომელი მიმართულებაა სასურველი, მისი რეაქციის სიჩქარის გამოვლენის გარეშე. ზოგიერთი რეაქცია შეიძლება იყოს თერმოდინამიკურად სასურველი, მაგრამ კინეტიკურად არახელსაყრელი.
მაგალითად, ალმასის გრაფიტად გადაქცევისას გრაფიტს უფრო დაბალი თავისუფალი ენერგია აქვს, ვიდრე ბრილიანტს, ამიტომ გარდაქმნას თერმოდინამიკურად ანიჭებენ უპირატესობას. ამასთან, არსებობს დიდი გააქტიურების ბარიერი ალმასისთვის, რომ გაწყვიტოს და ყველა ობლიგაცია უფრო მეტად მოახდინოს რეფორმირებაში გრაფიტის სტაბილური კონფიგურაცია, ამრიგად, ეს რეაქცია კინეტიკურად არახელსაყრელია და რეალურად არ მოხდება.
რეაქციის მაჩვენებელი
რეაქციის სიჩქარე არის პროდუქტის წარმოქმნისა და რეაქტივების მოხმარების სიჩქარის საზომი, ასე რომ თქვენ შეგიძლიათ განსაზღვროთ პროდუქციის ან რეაქტივების კონცენტრაციის ცვლილების გაზომვა, გარკვეული პერიოდის განმავლობაში. განვიხილოთ ზოგადი ქიმიური რეაქცია:
aA + bB> cC + dD
რეაქციის სიჩქარე შეიძლება დაიწეროს შემდეგნაირად:
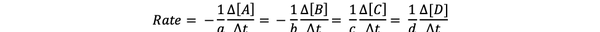
•••შეცვლილია დან https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
მაგალითად, რეაქციის სიჩქარე:
2 NO (g) + 2 H2 (ზ)> ნ2(ზ) + 2 სთ2ო (გ)
მოცემულია მიერ
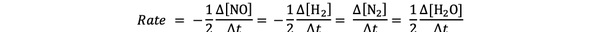
•••Ადაპტირებულია... დან https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
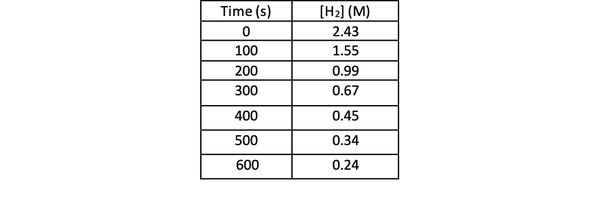
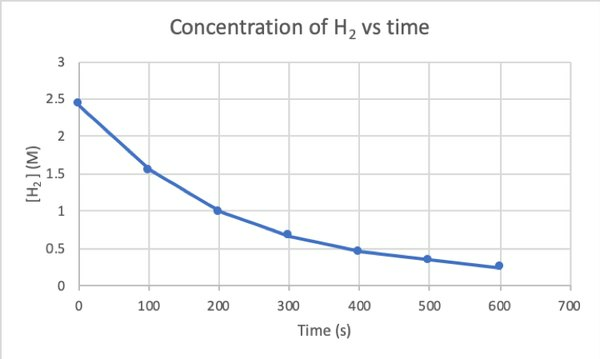
ექსპერიმენტის საშუალებით ამ რეაქციის სიჩქარის დასადგენად შეგიძლიათ H– ს კონცენტრაციის გაზომვა2 რეაქციის სხვადასხვა დროს და დროულად მოაწესრიგეთ იგი შემდეგნაირად:
•••შეცვლილია დან https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
•••შეცვლილია დან https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
რეაქციის საშუალო სიჩქარე არის რეაქციის სიჩქარის მიახლოება დროის ინტერვალში და შეიძლება აღინიშნოს შემდეგით:
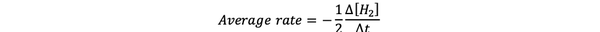
•••შეცვლილია დან https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
რეაქციის მყისიერი სიჩქარე განისაზღვრება, როგორც რეაქციის სიჩქარე დროში მყისიერად. ეს დიფერენციალური მაჩვენებელია და მისი გამოხატვა შეიძლება:
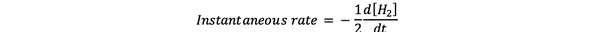
•••შეცვლილია დან https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
სადაც დ [ჰ2] / dt არის H კონცენტრაციის მრუდის დახრილი2 დროის დროს t.
რეაქციის საწყისი სიჩქარე არის მყისიერი სიჩქარე რეაქციის დასაწყისში, როდესაც t = 0. ამ შემთხვევაში, ერთეული საშუალო, მყისიერი და საწყისი რეაქციის სიჩქარეა M / s.
კანონის შეფასება
უმეტეს შემთხვევაში, რეაქციის სიჩქარე დამოკიდებულია t სხვადასხვა დროს სხვადასხვა რეაქტორების კონცენტრაციაზე. მაგალითად, ყველა რეაქტივის უფრო მაღალი კონცენტრაციის დროს, რეაქტივები უფრო ხშირად ეჯახება და იწვევს უფრო სწრაფ რეაქციას. ურთიერთქმედება რეაქციის სიჩქარეს ν (t) და კონცენტრაციებს შორის განისაზღვრება, როგორც განაკვეთი კანონი. ზოგადი ქიმიური რეაქციის aA + bB> cC + dD მაჩვენებელი კანონია:
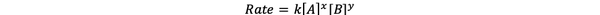
•••შეცვლილია დან https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
სადაც k არის სიჩქარის მუდმივა, ხოლო ძალა x და y არის შეკვეთა რეაქციის A და B რეაქციასთან დაკავშირებით. სიჩქარის კანონი უნდა განისაზღვროს ექსპერიმენტულად და არ შეიძლება დაანგარიშდეს მხოლოდ დაბალანსებული ქიმიური რეაქციის სტეიომეტრიიდან.
საწყისი ტარიფების მეთოდი
განაკვეთის კანონი შეიძლება განისაზღვროს საწყისი განაკვეთების მეთოდი. ამ მეთოდით, ექსპერიმენტი რამდენჯერმე ხორციელდება, მხოლოდ ერთი რეაქტორის კონცენტრაციის შეცვლა თითოეული დარბაზისთვის, ხოლო სხვა ცვლადების მუდმივა. რეაქციის სიჩქარე იზომება თითოეული პერსპექტივისთვის, რათა განისაზღვროს თითოეული რეაქტორის რიგითობა კანონში.
მაგალითად, განვიხილოთ შემდეგი საწყისი მაჩვენებლის მონაცემები რეაქციისთვის:
2 NO (g) + 2 H2 (ზ)> ნ2(ზ) + 2 სთ2ო (გ)
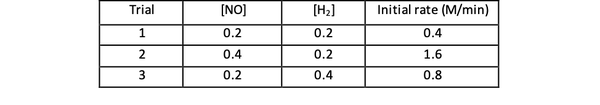
•••Ადაპტირებულია... დან https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
1 და 3 ცდისთვის NO კონცენტრაცია შენარჩუნებულია მუდმივად, H კონცენტრაცია2 გაორმაგებულია. შედეგად, რეაქციის საწყისი სიჩქარეც გაორმაგდა (იფიქრეთ მასზე, როგორც 2-ზე)1), ასე რომ თქვენ შეგიძლიათ დადოთ y = 1. 1 და 2 ცდისთვის NO კონცენტრაცია გაორმაგებულია, ხოლო H კონცენტრაცია2 მუდმივი რჩება. ამ ცვლილების შედეგია, რომ საწყისი კურსი გაიზარდა ოთხჯერ (იფიქრე მასზე, როგორც 2)2). თქვენ შეგიძლიათ დაასკვნოთ x = 2.
ამ რეაქციის მაჩვენებელი კანონია:
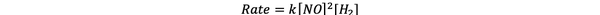
•••Ადაპტირებულია... დან https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
და რეაქცია არის პირველი შეკვეთა ჰ2 და მეორე რიგი არა.
