Una formula chimica è una notazione standard semplificata per spiegare una reazione chimica utilizzata negli esperimenti. Possono sembrare complicati, ma quando impari a leggerli, diventano abbastanza autoesplicativi.
Guarda la reazione chimica che stai cercando di scomporre come un'equazione. Cerca le parole chiave, in particolare i componenti chimici coinvolti. Ad esempio, il metano (CH4) viene bruciato, il che significa sempre che avviene in ossigeno (O2). Questo produce sia anidride carbonica (CO2) che vapore acqueo (H2O). Nota la posizione della parola "Rese", poiché è importante.
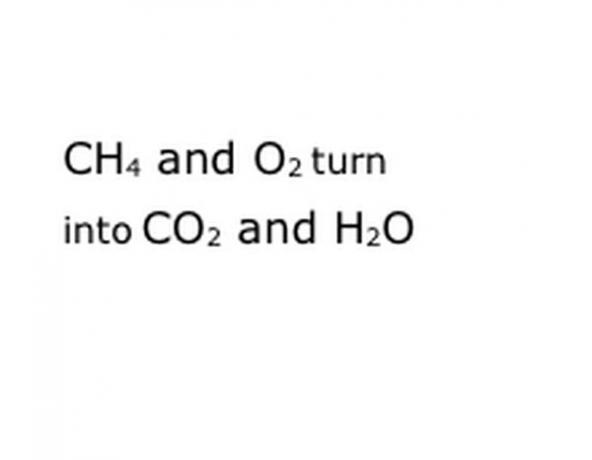
Scrivi i componenti chimici della reazione nel formato di notazione standard. Nel nostro esempio, questo sarà CH4, O2, CO2 e H2O. In chimica, "resa" significa che tutto ciò che è prima si trasforma in ciò che viene dopo, quindi assicurati che "resa" sia approssimativamente nel mezzo. Quella frase rappresenterà l'effettiva reazione chimica, in questo caso la combustione. Quindi tutto ciò che brucerai deve essere prima e tutto ciò che la reazione produce deve essere dopo.
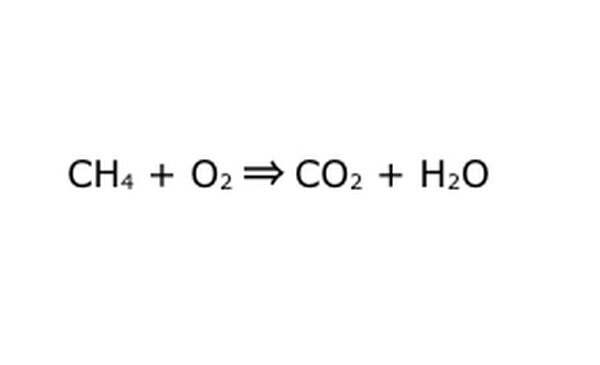
Riscrivi l'equazione come un processo matematico. Sostituisci "resa" o "trasforma in" con una freccia e traccia un segno più tra i componenti chimici. Per semplificare le cose, pensa a ogni componente chimico come a una singola molecola. Può essere utile estrarre le molecole su un pezzo di carta straccia. Assicurati che tutte le molecole che entrano siano rappresentate in uscita. Se c'è qualcosa che manca nel prodotto finale, puoi aggiungerlo in un modo che abbia senso: controlla qualsiasi cosa rispetto a ciò che sai sul legame covalente. Poiché la maggior parte degli esperimenti viene eseguita nell'atmosfera normale, è possibile aggiungere O2 se necessario alle reazioni di combustione. Se l'equazione è reversibile, assicurati che abbia una doppia freccia per rappresentarla.
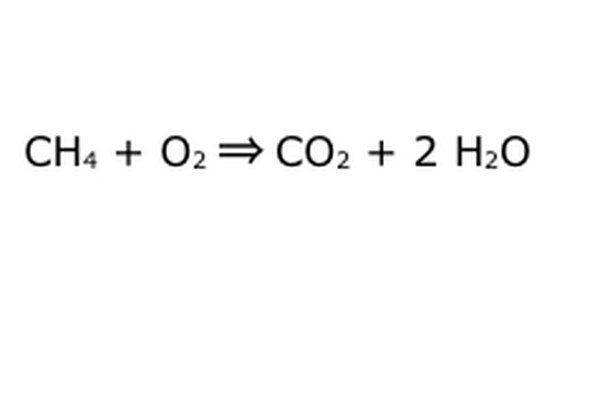
Bilancia la tua equazione. È qui che entra in gioco la Legge di Conservazione: pensa alla freccia, la nostra reazione, come una macchina nella quale hai scaricato tutti i componenti a sinistra. La macchina non creerà o aggiungerà nulla che non hai inserito, e quindi sputerà solo la stessa quantità di roba che hai inserito. In questo preciso momento, abbiamo due molecole di idrogeno in eccesso che fluttuano intorno, perché ci metti "4". L'unico posto in cui può andare in questa macchina è in uno dei prodotti, quindi dovrà andare nelle molecole d'acqua. Scrivi un "2" davanti a H2O per indicare che per ogni CH4 inserito, otterrai due H2O indietro.

Nota che c'è ancora un piccolo problema con la nostra equazione: non c'è abbastanza ossigeno che entra. Ci sono quattro atomi di ossigeno che escono, ma solo due entrano, e quindi l'intera cosa è ancora sbilanciata. Scrivi un "2" davanti all'O2 per rappresentare che devi inserire due O2 per ottenere abbastanza dalla reazione.
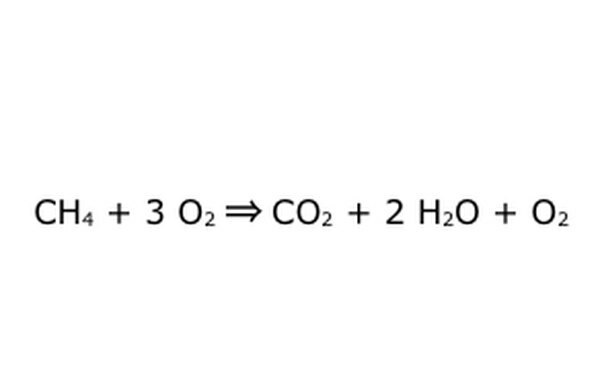
Nota che è possibile eseguire un processo come questo "in un eccesso di ossigeno". Ciò significa che l'equazione immette più ossigeno del necessario e ne ottiene di più. Per l'esempio, nota che c'è un O2 in più che entra, quindi c'è un altro che esce. Assicurati solo che la Legge di Conservazione sia sempre osservata. Tutto ciò che entra deve uscire.
Suggerimenti
Generalmente, le sostanze chimiche in questi tipi di equazioni sono misurate in moli. Una talpa è un'unità che rappresenta 6,0221415 10^(23) molecole. Poiché questo è un numero troppo grande da comprendere, è più facile pensare in termini di singole molecole durante il bilanciamento. Sii consapevole di questo quando inizi.
