Karbon adalah unsur nonlogam dengan lambang kimia C. Ini adalah unsur paling melimpah keempat di alam semesta, dan unsur paling melimpah ke-15 di kerak bumi. Ini juga merupakan unsur paling melimpah kedua pada manusia setelah oksigen. Susunan kimianya mengarah pada beberapa sifat unik karbon.
Karbon termasuk golongan 14 dari tabel periodik. Nomor atomnya adalah 6 dan memiliki berat atom 12,011. Tingkat oksidasi karbon dapat bervariasi dari -4 hingga +4, di mana +4 ada dalam senyawa seperti metana dan karbon disulfida, dan +2 untuk karbon monoksida.
Sifat fisik alotrop karbon yang berbeda membuatnya berguna dalam baterai, elektronik, dan bahan nano. Karbon juga merupakan “raja unsur”, membentuk hampir 10 juta senyawa sampai saat ini termasuk senyawa organik, anorganik dan organologam.
Isotop karbon banyak digunakan untuk penanggalan radiokarbon (karbon-14), struktur molekul dan penelitian medis (karbon-13). Selain itu, serat karbon menunjukkan sifat mekanik yang sangat baik dan populer di bidang kedirgantaraan dan teknik sipil.
Alotrop Karbon
Karbon memiliki perbedaan bentuk alotropik, dengan konfigurasi molekul dan struktur atom yang beragam. Sifat fisik karbon sangat bervariasi dengan masing-masing alotrop. Beberapa alotrop karbon yang paling terkenal termasuk grafit, berlian dan fullerene.
Grafit adalah salah satu bahan paling lembut yang diketahui dan digunakan dalam pensil dan sebagai pelumas padat. Ini juga merupakan konduktor listrik yang baik, sehingga berguna dalam baterai dan panel surya.
Grafena hanyalah satu lapisan atom grafit yang disusun dalam kisi sarang lebah. Dalam lapisan graphene, setiap atom karbon terikat secara kovalen dengan tiga atom lainnya, meninggalkan elektron keempat bebas untuk bermigrasi di pesawat, karenanya konduktivitas listriknya.
Berlian, sebaliknya, adalah zat alami yang paling keras dan merupakan salah satu sifat unik karbon. Ia memiliki hampir dua kali kerapatan grafit, dan setiap atom karbon terikat secara tetrahedral ke empat atom lainnya tanpa elektron yang mengalir bebas. Jadi berlian adalah konduktor listrik yang buruk. Berlian juga terlihat jelas, tidak seperti grafit, yang tidak tembus cahaya.
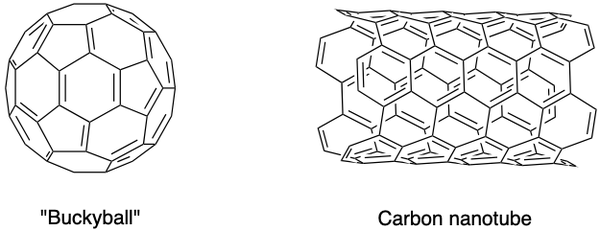
Para ilmuwan juga telah mensintesis alotrop karbon lainnya, seperti fullerene, carbon nanofoams dan lain-lain. Mereka memiliki sifat khusus dan merupakan bidang penelitian yang berkembang di bahan nano. Fullerene adalah sekelompok molekul karbon berongga dalam konformasi sangkar tertutup (buckyball) atau silinder (karbon nanotube).
•••Dibuat menggunakan ChemDraw
C60 buckyball ditemukan oleh Sir Harold Kroto, Richard Smalley dan Robert Curl Jr., menggunakan laser untuk menguapkan batang grafit dalam atmosfer helium. Atom karbon bergabung bersama oleh ikatan tunggal dan ganda untuk membentuk 12 wajah pentagonal dan 20 heksagonal dalam bentuk bola sepak. Upaya perintis mereka membuat mereka mendapatkan Hadiah Nobel pada tahun 1996.
Karbon nanotube, yang merupakan versi memanjang dari buckyballs, diidentifikasi oleh Iijima Sumio. Mereka adalah konduktor panas dan listrik yang sangat baik dan berguna untuk elektronik.
Karbon nanotube juga menunjukkan kekuatan tarik yang mengesankan dan memiliki aplikasi yang menarik dalam bahan struktural dan obat-obatan. Namun, sintesis terkontrol dari bahan nano semacam itu telah menimbulkan tantangan besar bagi para ilmuwan.
Reaktivitas Kimia Karbon
Karbon membentuk dasar kehidupan di Bumi, dengan jutaan senyawa yang mengandung karbon membentuk 18 persen dari semua makhluk hidup. Ini dapat membentuk ikatan kovalen yang stabil dengan atom lain dan muncul sebagai rantai panjang atau cincin dari ikatan karbon-karbon yang saling berhubungan kuat. Ini berkontribusi pada keragaman dan kompleksitas senyawa karbon yang ada di Bumi.
Ini senyawa karbon termasuk molekul organik seperti protein, karbohidrat dan DNA yang ditemukan dalam sel organisme hidup serta senyawa anorganik seperti karbon oksida. Studi tentang molekul organik merupakan bidang khusus yang disebut kimia organik. Karbon juga dapat membentuk ikatan kovalen dengan logam sebagai senyawa organologam. Porfirin besi, yang merupakan tempat pengikatan oksigen hemoglobin, adalah contohnya.
Meskipun berlimpah di alam, karbon relatif tidak reaktif dalam kondisi normal. Pada suhu standar, tidak reaktif terhadap asam (asam sulfat atau asam klorida) atau alkali. Hal ini juga stabil terhadap oksidasi pada suhu ini. Namun, pada suhu yang lebih tinggi, karbon dapat bereaksi dengan oksigen membentuk oksida karbon (CO .).2 dan CO), dengan gas belerang untuk membentuk karbon disulfida dan dengan silikon untuk membentuk karbida.
Isotop Karbon
Ada 15 isotop karbon yang diketahui, di mana karbon-12 (98,93 persen karbon alami) dan karbon-13 (1,07 persen) adalah dua isotop stabil. Karbon-14 adalah isotop yang berumur paling panjang, dengan waktu paruh 5.730 tahun. Isotop karbon berumur pendek adalah karbon-8, dan memiliki waktu paruh 1,98739 x 10−21 detik.
Isotop karbon-14 diwakili oleh 146C, di mana presuperscript 14 adalah massa atom dan presubscript 6 adalah nomor atom. Karbon-14 memiliki kelimpahan alami yang sangat rendah (0,0000000001 persen), tetapi waktu paruhnya yang panjang membuatnya berguna untuk penanggalan radiometrik.
Karbon-14 terbentuk ketika nitrogen-14 bereaksi dengan neutron dari radiasi kosmik, melepaskan proton dalam proses ini. Karbon-14 kemudian bereaksi dengan oksigen untuk menghasilkan 14BERSAMA2, yang terdistribusi secara merata di atmosfer dengan 12BERSAMA2.
147N + 10n > 146C + 11p
Siklus karbon dimulai ketika organisme hidup mengubah karbon dioksida (14BERSAMA2 dan 12BERSAMA2 dari atmosfer) menjadi senyawa organik melalui fotosintesis dan melepaskannya kembali ke atmosfer melalui respirasi. Dalam kesetimbangan ini, ada rasio tetap 14BERSAMA2 dan 12BERSAMA2 dalam organisme. Namun ketika mereka mati, keseimbangan berhenti, dan karbon-14 mengalami peluruhan beta menjadi nitrogen-14 menurut waktu paruh 5.730 tahun.
146C > 147N + 0-1e
Pengukuran proporsi relatif karbon-14 dalam spesimen mati memungkinkan penghitungan waktu yang berlalu setelah kematiannya. Metode penanggalan radiokarbon ini telah banyak digunakan untuk penanggalan fosil dan spesimen arkeologi dari 500 hingga 50.000 tahun.
Karbon-13 adalah isotop lain yang digunakan secara luas dalam banyak aplikasi. Misalnya, Ini digunakan dalam resonansi magnetik nuklir (NMR) untuk menentukan struktur molekul senyawa organik. Ini juga digunakan sebagai alat pelabelan dalam kombinasi dengan spektrometer massa untuk penelitian medis.
Sifat Mekanik Serat Karbon
Karbon juga menunjukkan sifat mekanik yang berguna, selain sifat fisik, kimia dan nuklirnya.
Itu bisa membentuk paduan dengan baja menjadi baja karbon, yang kandungan karbonnya bervariasi dari 0,05 hingga 2 persen berat. Baja karbon sedang (karbon 0,3-0,6 persen) memiliki kekuatan dan keuletan yang seimbang, serta kekuatan tarik yang sangat baik. Melalui proses perlakuan panas, baja karbon ultra-tinggi (1,25-2 persen karbon) dapat ditempa menjadi sangat keras dan digunakan untuk pembuatan pisau.
Serat karbon, yang merupakan serat setebal 5 hingga 10 m yang sebagian besar terdiri dari atom karbon, menunjukkan tinggi kekakuan, kekuatan tarik, ketahanan kimia, toleransi suhu dan bobot rendah dan termal ekspansi. Kekuatan luluh baja tergantung pada gradenya dan baja ringan memiliki kekuatan luluh 247 MPa. Serat karbon memiliki kekuatan tarik mulai dari 1.600 hingga 6.370 MPa dan karena itu populer di bidang kedirgantaraan, teknik sipil dan olahraga.
Ketika suatu tegangan diberikan pada suatu material, material tersebut mengalami deformasi elastis pada awalnya. Pada tahap ini, ia dapat kembali ke bentuk aslinya ketika tegangan dihilangkan. Kekuatan hasil didefinisikan sebagai tegangan yang dapat ditahan oleh suatu material tanpa deformasi permanen.
Ketika mencapai titik (titik luluh atas) di mana ia tidak dapat lagi kembali ke dimensi aslinya, ia mengalami deformasi plastis, yang bersifat permanen dan ireversibel. Kekuatan tarik adalah kekuatan maksimum yang dapat ditahan suatu bahan tanpa gagal atau putus.

