Kinetika je grana fizikalne kemije koja proučava brzinu kemijskih reakcija. Suprotno tome, termodinamika nam govori kojem smjeru reakcije se daje prednost, ne otkrivajući njezinu brzinu reakcije. Neke se reakcije mogu termodinamički favorizirati, ali kinetički favorizirati.
Na primjer, u pretvorbi dijamanta u grafit, grafit ima nižu slobodnu energiju od dijamanta, pa je pretvorba termodinamički pogodnija. Međutim, postoji velika aktivacijska prepreka da dijamant sve više pukne i reformira sve veze stabilna grafitna konfiguracija, pa je ova reakcija kinetički nepovoljna i zapravo se neće dogoditi.
Stopa reakcije
The brzina reakcije je mjera brzine stvaranja proizvoda i potrošnje reaktanata, tako da ga možete odrediti mjerenjem promjene koncentracije proizvoda ili reaktanata tijekom određenog vremenskog razdoblja. Razmotrimo opću kemijsku reakciju:
aA + bB> cC + dD
Brzina reakcije može se zapisati kao:
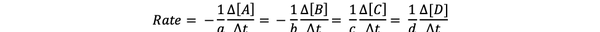
•••Izmijenjeno iz https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Na primjer, brzina reakcije za:
2 NO (g) + 2H2 (g)> N.2(g) + 2H2O (g)
dana je od
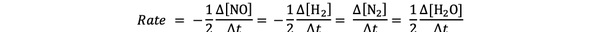
•••Prilagođeno iz https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
Da biste eksperimentom utvrdili brzinu ove reakcije, možete izmjeriti koncentraciju H2 u različito vrijeme reakcije i rasporedite je prema vremenu na sljedeći način:
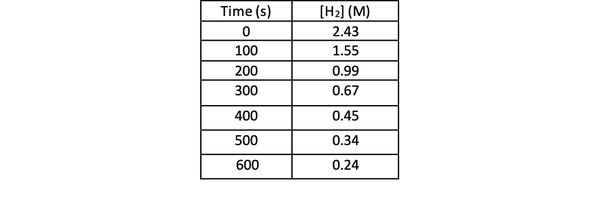
•••Izmijenjeno iz https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
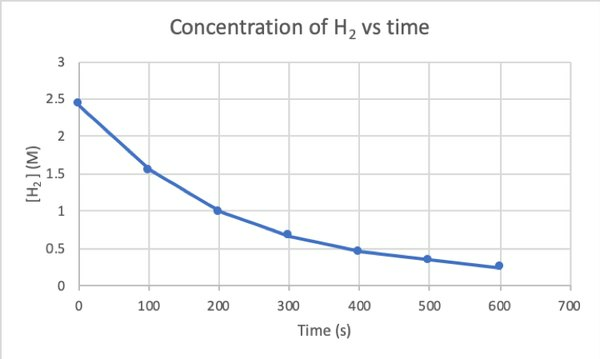
•••Izmijenjeno iz https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Experimental_Determination_of_Kinetcs/Measuring_Reaction_Rates
The prosječna brzina reakcije je aproksimacija brzine reakcije u vremenskom intervalu i može se označiti sa:
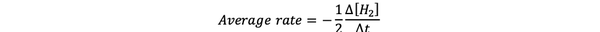
•••Izmijenjeno iz https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
The trenutna brzina reakcije definira se kao brzina reakcije u nekom trenutku u vremenu. To je diferencijalna stopa i može se izraziti:
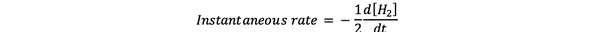
•••Izmijenjeno iz https://www.chem.purdue.edu/gchelp/howtosolveit/Kinetics/CalculatingRates.html#InitialRate
Gdje je d [H2] / dt je nagib za krivulju koncentracije H2 naspram vremena u vremenu t.
The početna brzina reakcije je trenutna brzina na početku reakcije, kada je t = 0. U ovom slučaju, jedinica za prosječnu, trenutnu i početnu brzinu reakcije je M / s.
Ocijenite zakon
U većini slučajeva brzina reakcije ovisi o koncentraciji različitih reaktanata u trenutku t. Na primjer, u većoj koncentraciji svih reaktanata, reaktanti se češće sudaraju i rezultiraju bržom reakcijom. Odnos između brzine reakcije ν (t) i koncentracija definiran je kao zakon o stopi. A zakon brzine za opću kemijsku reakciju aA + bB> cC + dD je:
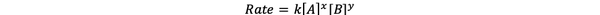
•••Izmijenjeno iz https://chem.libretexts.org/Bookshelves/Ancillary_Materials/Laboratory_Experiments/Wet_Lab_Experiments/General_Chemistry_Labs/Online_Chemistry_Lab_Manual/Chem_12_Experiments/01%3A_Chemical_Kinetics_-_The_Method_of_Initial_Rates_(Experiment)
Gdje je k konstanta brzine, a snaga x i y je narudžba reakcije s obzirom na reaktant A i B. Zakon brzine mora se odrediti eksperimentalno i ne može se izvesti samo iz stehiometrije uravnotežene kemijske reakcije.
Metoda početnih cijena
Zakon o stopi može odrediti metoda početnih stopa. U ovoj se metodi eksperiment izvodi više puta, mijenjajući samo koncentraciju jednog reaktanta za svaki postupak, a ostale varijable održava konstantnim. Brzina reakcije mjeri se za svaku seriju kako bi se odredio redoslijed svakog reaktanta u zakonu brzine.
Na primjer, uzmite u obzir sljedeće početne podatke o brzini reakcije:
2 NO (g) + 2H2 (g)> N.2(g) + 2H2O (g)
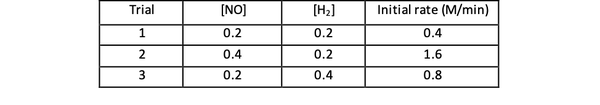
•••Prilagođeno iz https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
Za pokus 1 i 3 koncentracija NO održava se konstantnom, dok koncentracija H2 je udvostručen. Kao rezultat toga, početna brzina reakcije se također udvostručila (zamislite to kao 21), tako da možete zaključiti y = 1. Za pokus 1 i 2 koncentracija NO udvostručena je dok je koncentracija H2 ostaje konstantan. Rezultat ove promjene je da se početna stopa učetverostručila (zamislite to kao 22). Stoga možete zaključiti x = 2.
Zakon o stopi za ovu reakciju je stoga:
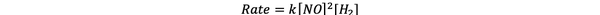
•••Prilagođeno iz https://www.chemteam.info/Kinetics/WS-Kinetics-method-of-initial-rates.html
I reakcija je prva narudžba u H2 i druga narudžba u BR.
