Aineen fysikaaliset ominaisuudet ovat suurimman osan fysiikasta. Aineen tilan, vaihemuutosten ja kemiallisten ominaisuuksien ymmärtämisen lisäksi aineesta keskustellessa on tärkeää ymmärtää fyysiset määrät, kuten tiheys (massa tilavuusyksikköä kohti), massa (aineen määrä) ja paine (voima yksikköä kohti) alue).
Atomit ja molekyylit
Jokapäiväinen asia kuin tunnet, on valmistettu atomista. Siksi atomeja kutsutaan yleisesti aineen rakennuspalikoiksi. Erilaisia atomeja on yli 109, ja ne edustavat kaikkia jaksollisen taulukon elementtejä.
Atomin kaksi pääosaa ovat ydin ja elektronikuori. Ydin on selvästi atomin raskain osa ja siellä on suurin osa massasta. Se on tiukasti sitoutunut alue atomin keskellä, ja massastaan huolimatta se vie suhteellisen vähän tilaa verrattuna muuhun atomiin. Ytimessä ovat protonit (positiivisesti varautuneet hiukkaset) ja neutronit (negatiivisesti varatut hiukkaset). Ytimen protonien lukumäärä määrittää, mikä elementti on atomi, ja eri lukumäärä neutroneja vastaa kyseisen elementin eri isotooppeja.
Elektronit ovat negatiivisesti varautuneita hiukkasia, jotka muodostavat hajanaisen pilven tai kuoren ytimen ympärille. Neutraalisti varautuneessa atomissa elektronien määrä on sama kuin protonien lukumäärä. Jos luku on erilainen, atomia kutsutaan ioniksi.
Molekyylit ovat atomeja, joita kemialliset sidokset pitävät yhdessä. Kemiallisia sidoksia on kolme päätyyppiä: ioniset, kovalenttiset ja metalliset. Ionisidoksia syntyy, kun negatiivinen ja positiivinen ioni houkuttelevat toisiaan. Kovalenttinen sidos on sidos, jossa kaksi atomia jakaa elektroneja. Metallisidokset ovat sidoksia, joissa atomit toimivat positiivisten ionien muodossa upotettuna vapaiden elektronien mereen.
Atomien ja molekyylien mikroskooppiset ominaisuudet johtavat makroskooppisiin ominaisuuksiin, jotka määräävät aineen käyttäytymisen. Molekyylien reaktio lämpötilan muutoksiin, sidosten lujuuteen ja niin edelleen johtaa kaikkiin ominaisuuksiin, kuten ominaislämpökapasiteetti, joustavuus, reaktiivisuus, johtavuus ja monet muut.
Aineen tilat
Aineen tila on yksi monista mahdollisista erillisistä muodoista, joissa aine voi esiintyä. Aineita on neljä: kiinteä, nestemäinen, kaasu ja plasma. Jokaisella tilalla on erilliset ominaisuudet, jotka erottavat sen muista tiloista, ja on vaiheiden siirtymisprosesseja, joilla aine muuttuu tilasta toiseen.
Kiinteiden aineiden ominaisuudet
Kun ajattelet kiinteää, luulet luultavasti jotain kovaa tai kiinteää jollain tavalla. Kiintoaineet voivat kuitenkin olla myös taipuisia, muodonmuutoksia ja muovattavia.
Kiinteät aineet erotetaan tiukasti sitoutuneista molekyyleistä. Kiinteässä tilassa aine on yleensä tiheämpi kuin nestemäisessä tilassaan (vaikka onkin poikkeuksia, etenkin vesi). Kiinteät aineet pitävät muotonsa ja kiinteän tilavuuden.
Yksi kiinteiden aineiden tyyppi on akiteinenkiinteä. Kiteisessä kiinteässä aineessa molekyylit on järjestetty toistuvaksi malliksi koko materiaaliin. Kiteet ovat helposti tunnistettavissa niiden makroskooppisen geometrian ja symmetrian perusteella.
Toinen kiinteän aineen tyyppi onamorfinenkiinteä. Tämä on kiinteä aine, jossa molekyylit eivät ole lainkaan järjestetty kideverkkoon. Amonikiteinenkiinteä on jossain välissä. Se koostuu usein pienistä, yksikiteisistä rakenteista, mutta ilman toistuvaa mallia.
Nesteiden ominaisuudet
Nesteet valmistetaan molekyyleistä, jotka voivat virrata helposti toistensa ohitse. Juotava vesi, öljy, jolla kypsennät, ja autosi bensiini ovat kaikki nesteitä. Toisin kuin kiinteät aineet, nesteet ottavat astiansa pohjan muodon.
Vaikka nesteet voivat laajentua ja supistua eri lämpötiloissa ja paineissa, nämä muutokset ovat usein pieniä, ja useimmissa käytännön tarkoituksissa voidaan olettaa, että nesteillä on myös kiinteä tilavuus. Nesteen molekyylit voivat virrata ohi toistensa.
Nesteen taipumusta olla hieman "tahmea" kiinnitettynä pintaan kutsutaantarttuvuusja nestemäisten molekyylien kykyä haluta tarttua yhteen (esimerkiksi kun vesipisara muodostaa pallon lehdelle) kutsutaanyhteenkuuluvuutta.
Nesteessä paine riippuu syvyydestä, ja tämän vuoksi upotetut tai osittain veden alla olevat esineet tuntevat kohoavan voiman, joka johtuu paine-erosta kohteen ylä- ja alaosassa. Archimedeksen periaate kuvaa tätä vaikutusta ja selittää kuinka esineet kelluvat tai uppoavat nesteissä. Se voidaan tiivistää lausunnolla, että "kelluva voima on yhtä suuri kuin siirtyneen nesteen paino". Sellaisena kelluva voima riippuu nesteen tiheydestä ja kohteen koosta. Nesteitä tiheämmät esineet uppoavat, ja vähemmän tiheät kelluvat.
Kaasujen ominaisuudet
Kaasut sisältävät molekyylejä, jotka voivat liikkua helposti toistensa ympäri. Ne ottavat kontinsa koko muodon ja tilavuuden ja laajenevat ja supistuvat helposti. Tärkeitä kaasun ominaisuuksia ovat paine, lämpötila ja tilavuus. Itse asiassa nämä kolme määrää ovat riittäviä kuvaamaan täydellisen ihanteellisen kaasun makroskooppista tilaa.
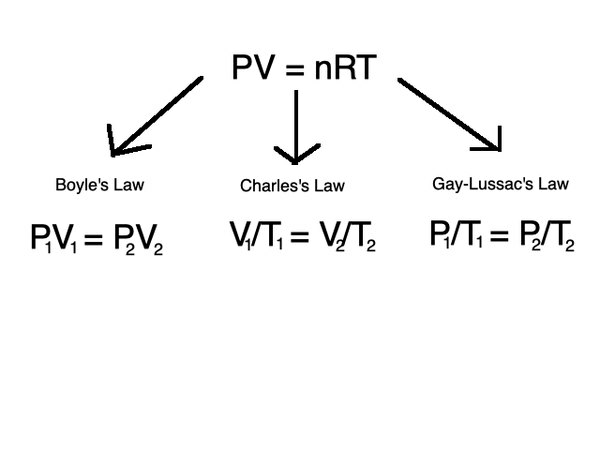
Ihanteellinen kaasu on kaasu, jossa molekyylit voidaan arvioida pistehiukkasiksi ja jossa oletetaan, että ne eivät ole vuorovaikutuksessa toistensa kanssa. Ihanteellinen kaasulaki kuvaa monien kaasujen käyttäytymistä ja se annetaan kaavan avulla
PV = nRT
missäPon paine,Von äänenvoimakkuus,non aineen moolien lukumäärä,Ron ihanteellinen kaasuvakio (R= 8,3145 J / molK) jaTon lämpötila.
Tämän lain vaihtoehtoinen muotoilu on
PV = NkT
missäNon molekyylien lukumäärä jakon Boltzmannin vakio (k = 1.38065 × 10-23 J / K). (Skeptinen lukija voi varmistaa sennR = Nk.)
Kaasut myös käyttävät kelluvia voimia niihin upotettuihin esineisiin. Vaikka suurin osa jokapäiväisistä esineistä on tiheämpää kuin ympäröivä ilma, joten tämä kelluva voima ei ole kovin havaittavissa, heliumpallo on täydellinen esimerkki tästä.
Plasman ominaisuudet
Plasma on kaasu, josta on tullut niin kuuma, että elektronit pyrkivät poistumaan atomista jättäen positiivisia ioneja elektronimerelle. Koska plasmassa on yhtä suuri määrä positiivisia ja negatiivisia varauksia, sitä pidetään lähes neutraali, vaikka varausten erottaminen ja paikallinen kasaantuminen aiheuttaa plasman käyttäytymisen hyvin eri tavalla kuin a tavallinen kaasu.
Plasmaan vaikuttavat merkittävästi sähkö- ja magneettikentät. Näiden kenttien ei myöskään tarvitse olla ulkoisia, koska plasman varaukset itse luovat liikkuessaan sähkökenttiä ja magneettikenttiä, jotka vaikuttavat toisiinsa.
Alemmissa lämpötiloissa ja energioissa elektronit ja ionit haluavat yhdistyä neutraaleiksi atomeiksi, joten plasmatilan ylläpitäminen vaatii yleensä korkeita lämpötiloja. Kuitenkin voidaan luoda niin kutsuttu ei-terminen plasma, jossa elektronit itse ylläpitävät korkeaa lämpötilaa, kun taas ionisoidut ytimet eivät. Tätä tapahtuu esimerkiksi loistelampun elohopeahöyrykaasussa.
"Normaalin" kaasun ja plasman välillä ei välttämättä ole erillistä rajaa. Kaasun atomit ja molekyylit voivat ionisoida asteittain, mikä osoittaa enemmän plasmamaista dynamiikkaa, mitä lähempänä kaasu tulee täysin ionisoitumaan. Plasma erotetaan tavallisista kaasuista sen korkean sähkönjohtavuuden avulla, sillä se toimii kuin järjestelmä, jossa on kahden tyyppisiä hiukkasia (positiiviset ionit ja negatiiviset elektronit) toisin kuin järjestelmässä, jossa on yhtä tyyppiä (neutraalit atomit tai molekyylit), ja hiukkasten törmäykset ja vuorovaikutukset, jotka ovat paljon monimutkaisempia kuin kahden rungon "poolipallon" vuorovaikutukset standardissa kaasu.
Esimerkkejä plasmasta ovat salama, maapallon ionosfääri, loisteputkivalo ja auringon kaasut.
Vaihemuutokset
Aineella voi olla fyysinen muutos vaiheesta tai tilasta toiseen. Tärkeimmät tähän muutokseen vaikuttavat tekijät ovat paine ja lämpötila. Yleensä kiinteän aineen on oltava lämmin, jotta se muuttuu nesteiksi, nesteen on lämmitettävä muuttuakseen kaasuksi, ja kaasun on lämmitettävä, jotta se ionisoituu ja siitä tulee plasma. Lämpötilat, joissa nämä siirtymät tapahtuvat, riippuvat itse materiaalista ja paineesta. Itse asiassa on mahdollista siirtyä suoraan kiinteästä aineesta kaasuksi (tätä kutsutaan sublimoitumiseksi) tai kaasusta kiinteäksi aineeksi (laskeuma) oikeissa olosuhteissa.
Kun kiinteä aine kuumennetaan sulamispisteeseen, siitä tulee nestettä. Lämpöenergia on lisättävä kiinteän aineen lämmittämiseksi sulamislämpötilaan, ja sitten on lisättävä lämpöä vaihesiirtymän loppuunsaattamiseksi ennen kuin lämpötila voi jatkaa nousua.piilevä fuusiolämpöon vakio, joka liittyy kuhunkin tiettyyn materiaaliin, joka määrittää kuinka paljon energiaa tarvitaan aineen massayksikön sulattamiseksi.
Tämä toimii myös toiseen suuntaan. Nesteen jäähtyessä sen on luovutettava lämpöenergiaa. Kun se on saavuttanut jäätymispisteen, sen on edelleen luovutettava energiaa vaihesiirtymän suorittamiseksi ennen kuin lämpötila voi edelleen laskea.
Samanlainen käyttäytyminen tapahtuu, kun neste kuumennetaan kiehumispisteeseen. Lämpöenergiaa lisätään, jolloin lämpötila nousee, kunnes se alkaa kiehua, jolloin lisätty lämpöenergia käytetään aiheuttaa vaihemuutoksen, ja syntyvän kaasun lämpötila ei nouse ennen kuin kaikki neste on muuttunut vaihe. Vakio, jota kutsutaanpiilevä höyrystyslämpömäärittää tietylle aineelle, kuinka paljon energiaa tarvitaan aineen vaiheen muuttamiseksi nestemäisestä kaasuksi massayksikköä kohti. Aineen piilevä höyrystyslämpö on yleensä paljon suurempi kuin piilevä fuusiolämpö.
Kemialliset ominaisuudet
Aineen kemialliset ominaisuudet määräävät, minkä tyyppisiä kemiallisia reaktioita tai kemiallisia muutoksia voi tapahtua. Kemialliset ominaisuudet eroavat fysikaalisista ominaisuuksista siinä mielessä, että niiden mittaamiseksi tarvitaan jonkinlainen kemiallinen muutos.
Esimerkkejä kemiallisista ominaisuuksista ovat syttyvyys (kuinka helposti materiaali voi palaa), reaktiivisuus (kuinka helposti se käy läpi) kemialliset reaktiot), stabiilisuus (kuinka todennäköistä on vastustaa kemiallisia muutoksia) ja sidostyypit, joita materiaali voi muodostaa muiden kanssa materiaaleja.
Kun tapahtuu kemiallinen reaktio, atomien väliset sidokset muuttuvat ja muodostuu uusia aineita. Yleisiä kemiallisten reaktioiden tyyppejä ovat yhdistelmä (jossa kaksi tai useampi molekyyli yhdistyy muodostaen uuden molekyylin), hajoaminen (jossa molekyyli hajoaa kahteen osaan) tai useampia eri molekyylejä) ja palaminen (jossa yhdisteet yhdistyvät hapen kanssa, jolloin vapautuu merkittäviä määriä lämpöä - jota kutsutaan yleisemmin "polttavaksi") harvat.