Eine chemische Formel ist eine vereinfachte Standardschreibweise zur Erklärung einer chemischen Reaktion, die in Experimenten verwendet wird. Sie mögen kompliziert aussehen, aber wenn Sie lernen, sie zu lesen, werden sie ziemlich selbsterklärend.
Betrachten Sie die chemische Reaktion, die Sie als Gleichung aufzulösen versuchen. Suchen Sie nach Schlüsselwörtern, insbesondere nach den beteiligten chemischen Komponenten. Methan (CH4) wird zum Beispiel verbrannt, was immer bedeutet, dass es in Sauerstoff (O2) erfolgt. Dabei entstehen sowohl Kohlendioxid (CO2) als auch Wasserdampf (H2O). Beachten Sie die Position des Wortes "Erträge", da dies wichtig ist.
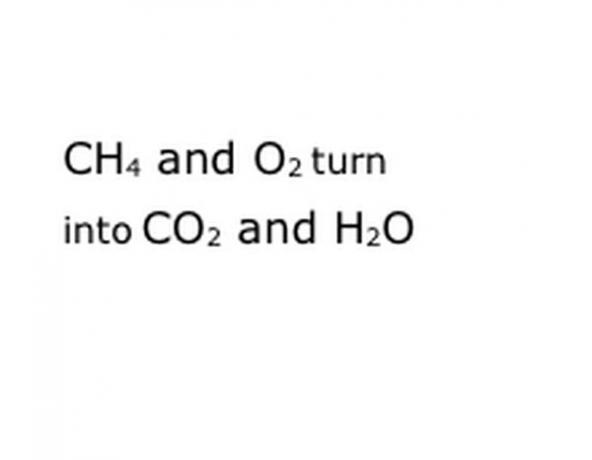
Schreiben Sie die chemischen Komponenten der Reaktion im Standardnotationsformat. In unserem Beispiel sind dies CH4, O2, CO2 und H2O. In der Chemie bedeutet "Ausbeute", dass das, was vorher war, in das wird, was danach kommt, also stellen Sie sicher, dass "Ausbeute" ungefähr in der Mitte liegt. Dieser Ausdruck repräsentiert die eigentliche chemische Reaktion, in diesem Fall die Verbrennung. Also muss alles, was Sie verbrennen, davor sein, und alles, was die Reaktion ergibt, muss danach sein.
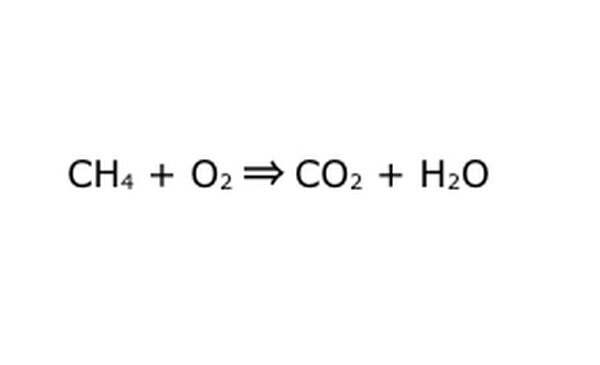
Schreiben Sie die Gleichung als mathematischen Prozess um. Ersetzen Sie "Ausbeute" oder "wird in" durch einen Pfeil und zeichnen Sie Pluszeichen zwischen den chemischen Komponenten. Stellen Sie sich zur Vereinfachung jede chemische Komponente als einzelnes Molekül vor. Es kann hilfreich sein, die Moleküle auf einem Stück Papier zu zeichnen. Stellen Sie sicher, dass alle Moleküle, die hineingehen, beim Herauskommen dargestellt werden. Wenn im Endprodukt etwas fehlt, können Sie dies sinnvoll hinzufügen – vergleichen Sie alles mit Ihrem Wissen über kovalente Bindungen. Da die meisten Experimente in der regulären Atmosphäre durchgeführt werden, können Sie bei Bedarf O2 zu Verbrennungsreaktionen hinzufügen. Wenn die Gleichung umkehrbar ist, stellen Sie sicher, dass sie einen Doppelpfeil hat, um dies darzustellen.
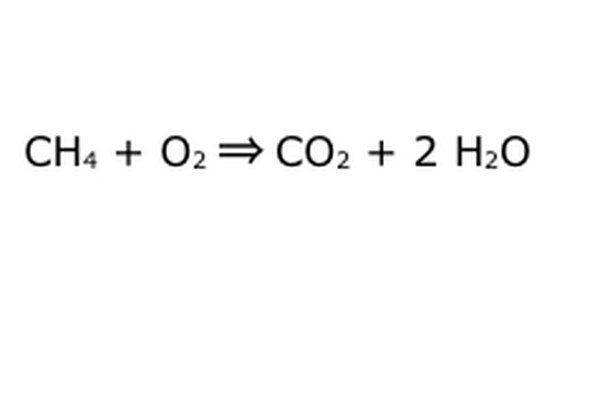
Balanciere deine Gleichung. Hier kommt das Gesetz der Erhaltung ins Spiel: Stellen Sie sich den Pfeil, unsere Reaktion, als eine Maschine vor, in die Sie alle Komponenten auf der linken Seite geworfen haben. Die Maschine produziert oder fügt nichts hinzu, was Sie nicht eingegeben haben, und spuckt daher nur die gleiche Menge aus, die Sie eingegeben haben. Genau in diesem Moment schweben zwei überschüssige Wasserstoffmoleküle herum, weil Sie "4" eingeben. Der einzige Ort, an den es in diese Maschine gelangen kann, ist eines der Produkte, also muss es in die Wassermoleküle gelangen. Schreiben Sie eine "2" vor das H2O, um anzuzeigen, dass Sie für jedes CH4, das Sie einfüllen, zwei H2O zurückerhalten.

Beachten Sie, dass es noch ein kleines Problem mit unserer Gleichung gibt: Es wird nicht genug Sauerstoff zugeführt. Es kommen vier Sauerstoffatome heraus, aber nur zwei gehen hinein, und so ist das Ganze immer noch unausgeglichen. Schreiben Sie eine "2" vor das O2, um darzustellen, dass Sie zwei O2 eingeben müssen, um genug aus der Reaktion herauszuholen.
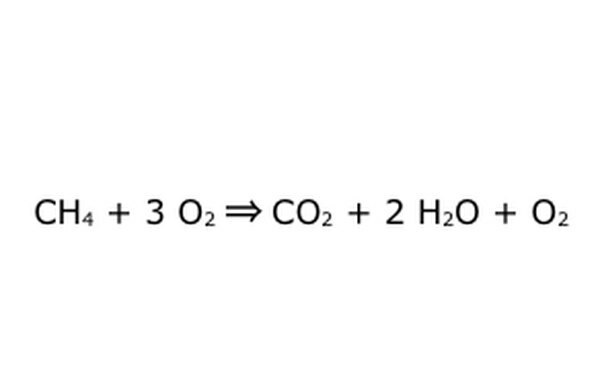
Beachten Sie, dass es möglich ist, einen Vorgang wie diesen "in einem Überschuss an Sauerstoff" durchzuführen. Dies bedeutet, dass die Gleichung mehr Sauerstoff einbringt als benötigt wird und mehr zurückbekommt. Beachten Sie für das Beispiel, dass ein zusätzlicher O2 hereinkommt, also ein zusätzlicher herauskommt. Stellen Sie nur sicher, dass das Gesetz der Erhaltung jederzeit eingehalten wird. Alles was reingeht, muss raus.
Tipps
Im Allgemeinen werden Chemikalien in diesen Gleichungstypen in Mol gemessen. Ein Mol ist eine Einheit, die 6.0221415 10^(23) Moleküle darstellt. Da diese Zahl viel zu groß ist, um sie zu verstehen, ist es beim Bilanzieren einfacher, in einzelnen Molekülen zu denken. Beachten Sie dies beim Start.
