En kemisk formel er en forenklet standardnotation til forklaring af en kemisk reaktion anvendt i eksperimenter. De kan se komplicerede ud, men når du lærer at læse dem, bliver de ret selvforklarende.
Se på den kemiske reaktion, du prøver at nedbryde som en ligning. Se efter nøgleord, specifikt de involverede kemiske komponenter. For eksempel brændes metan (CH4), hvilket altid betyder, at det sker i ilt (O2). Dette giver både kuldioxid (CO2) og vand (H2O) damp. Bemærk placeringen af ordet "Yields", da dette er vigtigt.
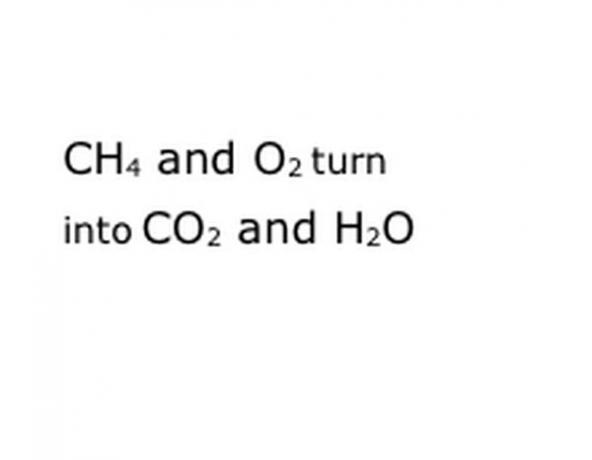
Skriv reaktionens kemiske komponenter i standardnotationsformatet. I vores eksempel vil dette være CH4, O2, CO2 og H2O. I kemi betyder "udbytte", at alt, hvad der er før, bliver til det, der kommer efter, så sørg for, at "udbytte" er omtrent i midten. Denne sætning repræsenterer den egentlige kemiske reaktion, i dette tilfælde brændingen. Så alt, hvad du vil brænde, skal være før det, og alt hvad reaktionen giver, skal være efter.
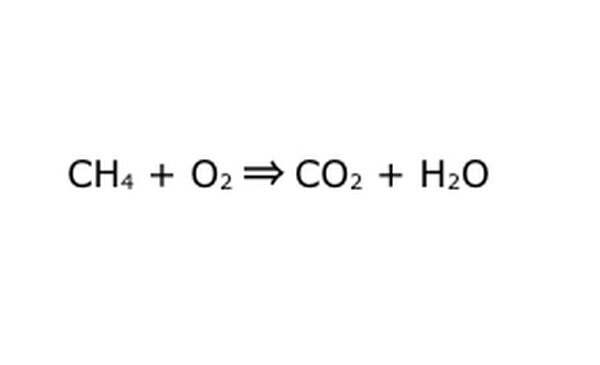
Omskriv ligningen som en matematisk proces. Udskift "udbytte" eller "bliver til" med en pil, og tegn plustegn mellem de kemiske komponenter. For at forenkle tingene skal du tænke på hver kemisk komponent som et individuelt molekyle. Det kan hjælpe med at trække molekylerne ud på et stykke skrotpapir. Sørg for, at alle de molekyler, der går ind, er repræsenteret, når de kommer ud. Hvis der mangler noget i slutproduktet, kan du tilføje det på en måde, der giver mening - tjek alt, hvad du ved om kovalent binding. Da de fleste eksperimenter udføres i den almindelige atmosfære, kan du om nødvendigt tilføje O2 til brændende reaktioner. Hvis ligningen er reversibel, skal du sørge for, at den har en dobbeltpil, der repræsenterer det.
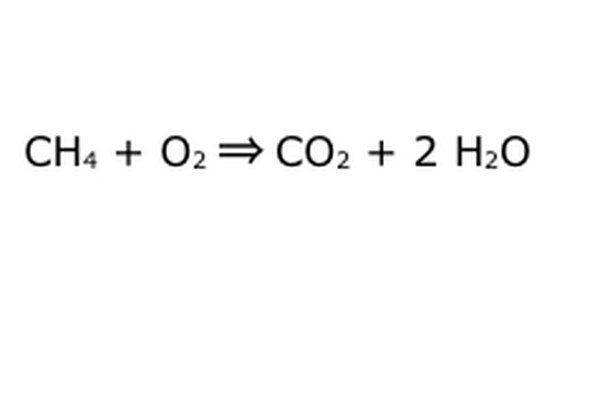
Balance din ligning. Det er her, konserveringsloven kommer i spil: tænk på pilen, vores reaktion, som en maskine, som du har dumpet alle komponenterne til venstre i. Maskinen laver eller tilføjer ikke noget, du ikke har lagt i, og derfor spytter den kun den samme mængde ting, du har lagt i. I dette nøjagtige øjeblik har vi to overskydende brintmolekyler, der flyder rundt, fordi du lægger "4" i. Det eneste sted, det kan gå i denne maskine, er i et af produkterne, så det bliver nødt til at gå ind i vandmolekylerne. Skriv en "2" foran H2O for at indikere, at for hver CH4, du lægger i, får du to H2O tilbage.

Bemærk, at der stadig er et lille problem med vores ligning: der kommer ikke nok ilt ind. Der kommer fire iltatomer ud, men kun to går ind, og så er det hele stadig ubalanceret. Skriv en "2" foran O2 for at repræsentere, at du skal sætte to O2 i for at få nok ud af reaktionen.
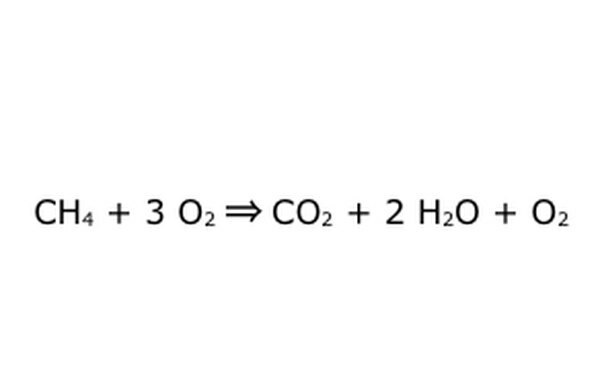
Bemærk, at det er muligt at udføre en sådan proces "i et overskud af ilt." Hvad dette betyder er, at ligningen lægger mere ilt i end nødvendigt, og får mere tilbage. For eksempel skal du bemærke, at der er en ekstra O2, der kommer ind, så der kommer en ekstra ud. Bare vær sikker på at loven om bevarelse overholdes til enhver tid. Alt, hvad der går ind, skal komme ud.
Tips
Generelt måles kemikalier i disse typer ligninger i mol. En mol er en enhed, der repræsenterer 6.0221415 10 ^ (23) molekyler. Da dette er et tal, der er alt for stort til at forstå, er det lettere at tænke i form af enkeltmolekyler, når man balancerer. Vær opmærksom på dette, når du starter.
