Elektrokemiske celler fortæller dig om, hvordan batterier oplader kredsløb, og hvordan elektroniske enheder som mobiltelefoner og digitale ure får strøm. Når man ser på E-cellekemi, potentialet i elektrokemiske celler, finder du kemiske reaktioner, der driver dem, der sender elektrisk strøm gennem deres kredsløb. PotentialetEaf en celle kan fortælle dig, hvordan disse reaktioner opstår.
Beregning af E-celle
•••Syed Hussain Ather
Tips
Manipuler halvreaktionerne ved at omarrangere dem, multiplicere dem med heltal, vende tegnet på det elektrokemiske potentiale og multiplicere potentialet. Sørg for at følge reglerne for reduktion og oxidation. Summ de elektrokemiske potentialer for hver halvreaktion i en celle for at få det totale elektrokemiske eller elektromotoriske potentiale for en celle.
For at beregneelektromotorisk potentiale, også kendt som potentialet for den elektromotoriske kraft (EMF), af engalvaniskeller voltaisk celle ved hjælp af E-celleformlen ved beregning af E-celle:
- Opdel ligningen i halve reaktioner, hvis den ikke allerede er.
- Bestem hvilken ligning (er), hvis nogen, skal vendes eller ganges med et heltal. Du kan bestemme dette ved først at finde ud af, hvilke halve reaktioner der mest sandsynligt vil forekomme i en spontan reaktion. Jo mindre størrelsen af det elektrokemiske potentiale for en reaktion er, desto mere sandsynligt er det. Det samlede reaktionspotentiale skal dog forblive positivt.
- For eksempel en halv reaktion med elektrokemisk potentiale på-.5 V.er mere tilbøjelige til at forekomme end en med potentiale1 V.
- Når du har bestemt, hvilke reaktioner der mest sandsynligt vil forekomme, danner de grundlaget for den oxidation og reduktion, der anvendes i den elektrokemiske reaktion.
- Vend ligninger og multiplicer begge sider af ligninger med heltal, indtil de opsummerer til den samlede elektrokemiske reaktion, og elementerne på begge sider annulleres. For enhver ligning, du vender, skal du vende tegnet. For enhver ligning, du ganger med et heltal, skal du gange potentialet med det samme heltal.
- Opsummer de elektrokemiske potentialer for hver reaktion under hensyntagen til negative tegn.
Du kan huske E-celle ligningens katode anode med den mnemoniske "Red Cat An Ox", der fortæller digrødfunktion optræder vedkathode ogenodeokseidiserer.
Beregn elektrodepotentialerne for de følgende halvceller
For eksempel kan vi have en galvanisk celle med en jævnstrømskilde. Det bruger følgende ligninger i et klassisk AA alkalisk batteri med tilsvarende elektrokemiske halvreaktionspotentialer. Beregning af e-celle er let ved hjælp afEcelleligning for katoden og anoden.
- MnO2(s) + H2O + e− → MnOOH (s) + OH-(aq); Eo= +0,382 V
- Zn (s) + 2 OH -(aq) → Zn (OH)2(s) + 2e-; Eo = +1,211 V
I dette eksempel beskriver den første ligning vandH2Oreduceres ved at miste en proton (H+) at danneOH- mens magnesiumoxidMnO2oxideres ved at få en proton (H+) til dannelse af manganoxid-hydroxidMnOOH.Den anden ligning beskriver zinkZnbliver oxideret med to hydroxidionerOH - til dannelse af zinkhydroxid Zn (OH)2 mens du frigiver to elektroner.
For at danne den samlede elektrokemiske ligning, vi ønsker, skal du først bemærke, at ligning (1) er mere tilbøjelig til at forekomme end ligning (2), fordi den har en lavere størrelse af elektrokemisk potentiale. Denne ligning er en reduktion af vandH2Otil dannelse af hydroxidOH-og oxidation af magnesiumoxidMnO2. Dette betyder, at den tilsvarende proces i den anden ligning skal oxidere hydroxidOH-at vende den tilbage til vandH2O.For at opnå dette skal du reducere zinkhydroxidZn (OH)2tilbage til zinkZn.
Dette betyder, at den anden ligning skal vendes. Hvis du vender det og ændrer tegnet på det elektrokemiske potentiale, opnår duZn (OH)2(s) + 2e- → Zn (s) + 2 OH -(aq) med et tilsvarende elektrokemisk potentialeEo = -1,221 V.
Før du sammenfatter de to ligninger, skal du gange hver reaktant og hvert produkt af den første ligning med heltal 2 for at sikre, at de 2 elektroner i den anden reaktion afbalancerer den enkelte elektron fra den første en. Dette betyder, at vores første ligning bliver 2MnO2(s) + 2 H2O + 2e− → 2MnOOH (s) + 2OH-(aq)med et elektrokemisk potentiale påEo= +0,764 V
Tilføj disse to ligninger sammen og de to elektrokemiske potentialer sammen for at få en kombineret reaktion: 2MnO2(s) + 2 H2O + Zn (OH)2(s) → Zn (s) + MnOOH (s)med elektrokemisk potentiale-0,457 V. Bemærk, at de 2 hydroxidioner og de 2 elektroner på begge sider slettes, når ECell-formlen oprettes.
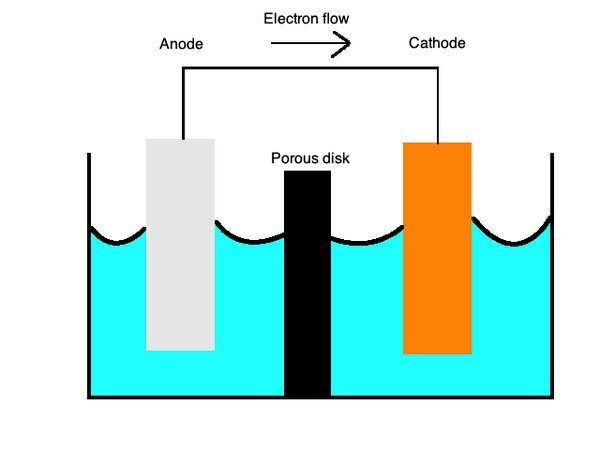
E cellekemi
Disse ligninger beskriver oxidations- og reduktionsprocesserne med en semi-porøs membran adskilt af en saltbro. Detsaltbroer lavet af et materiale såsom kaliumsulfat, der tjener som n inaktiv elektrolyt, der lader ion diffundere over overfladen.
Vedkatoder, oxidation eller tab af elektroner, forekommer og vedanoder, reduktion eller forstærkning af elektroner opstår. Du kan huske dette med det hukommelige ord "OILRIG." Det fortæller dig, at "Oxidation Is Loss" ("OIL") og "Reduction Is Gain" ("RIG"). Elektrolytten er væsken, der lader ioner strømme gennem begge disse dele af cellen.
Husk at prioritere ligninger og reaktioner, der er mere tilbøjelige til at forekomme, fordi de har en lavere elektrokemisk potentiale. Disse reaktioner danner grundlaget for galvaniske celler og al deres anvendelse, og lignende reaktioner kan forekomme i biologiske sammenhænge. Cellemembraner genererer transmembrant elektrisk potentiale, når ioner bevæger sig over membranen og gennem elektromotoriske kemiske potentialer.
For eksempel er omdannelsen af reduceret nicotinamidadenindinucleotid (NADH) i tilstedeværelsen protoner (H+) og molekylært ilt (O2) producerer sin oxiderede modstykke (NAD+) ved siden af vand (H2O) som en del af elektrontransportkæden. Dette sker med en protonelektrokemisk gradientforårsaget af potentialet for at lade oxidativ fosforylering forekomme i mitokondrier og producere energi.
Nernst ligning
DetNernst ligninglader dig beregne det elektrokemiske potentiale ved hjælp af koncentrationer af produkter og reaktanter i ligevægt med cellepotentiale i voltEcelle som
E_ {celle} = E_ {celle} ^ - \ frac {RT} {zF} \ ln {Q}
hvoriE-celle er potentialet for reduktionshalvreaktionen,Rer den universelle gaskonstant (8,31 J x K − 1 mol − 1), Ter temperaturen i Kelvins,zer antallet af elektroner, der overføres i reaktionen, ogQer reaktionskvotienten for den samlede reaktion.
ReaktionskvotientenQer et forhold, der involverer koncentrationer af produkter og reaktanter. Til den hypotetiske reaktion:aA + bB ⇌ cC + dDmed reaktanterENogB, ProdukterCogDog tilsvarende heltalværdier-en, b, cogd, reaktionskvotientenQville væreQ = [C]c[D]d / [A]-en[B]bmed hver parentesværdi som koncentration, normalt imol / l. For ethvert eksempel måler reaktionen denne ration af produkter til reaktanter.
Potentialet for en elektrolytisk celle
Elektrolytiske celleradskiller sig fra galvaniske celler, fordi de bruger en ekstern batterikilde, ikke det naturlige elektrokemiske potentiale, til at drive elektricitet gennem kredsløbet. kan bruge elektroder inde i elektrolytten i en ikke-spontan reaktion.
Disse celler bruger også en vandig eller smeltet elektrolyt i modsætning til saltbroen af galvaniske celler. Elektroderne matcher den positive terminal, anoden og den negative terminal, katoden, på batteriet. Mens galvaniske celler har positive EMF-værdier, har elektrolytiske celler negative, hvilket betyder, at f.eks galvaniske celler, forekommer reaktionerne spontant, mens elektrolytiske celler kræver en ekstern spænding kilde.
I lighed med de galvaniske celler kan du manipulere, vende, multiplicere og tilføje halvreaktionsligningerne for at producere den samlede elektrolytiske celleligning.
